電池ってあまり意識していませんが、本当にいろんなところで使われていますよね。大きな電力が欲しいときは、コンセントからコードで引っ張ってきますが、それほど大きな電力が必要でない場合や、コンセントからコードで引っ張ってこられない場合などは電池式になっている場合が多く見かけます。
例えば、時計、電卓、各種リモコン、デジタルカメラ、スマホ、電動玩具、懐中電灯、シェーバー、拡声器、ワイヤレスマイクなど。数え上げたらきりがありません。
特に最近注目されているのが、電気自動車。この場合は、今までの電池とは比べ物にならないような大容量の電池が使われています。この場合はコードで電気を持ってくるわけにはいかないから電池ということになります。
では電池って何なのか。どうして電気が得られるのでしょうか。意外に知らない人が多いのではないでしょうか。
電池には一回しか使えない一次電池と、充電して何回でも使える二次電池(蓄電池)がありますが、ここでは一次電池について、なぜ電気が得られるのか説明したいと思います。
電池の構造は超簡単
実は電池の構造はすごく簡単です。種類の違う金属を電解液という液体の中に浸してあるだけ。その二つの金属を導線でつなぐと、その導線に電気が流れます(使う金属の種類をうまく選ぶ必要がありますが)。これが電池です。ここで電解液って言葉が出てきましたが難しいものではありません。電解液というのは電気を通す液体のことで、水に少量の酸やアルカリ、塩類を入れればできてしまいます。
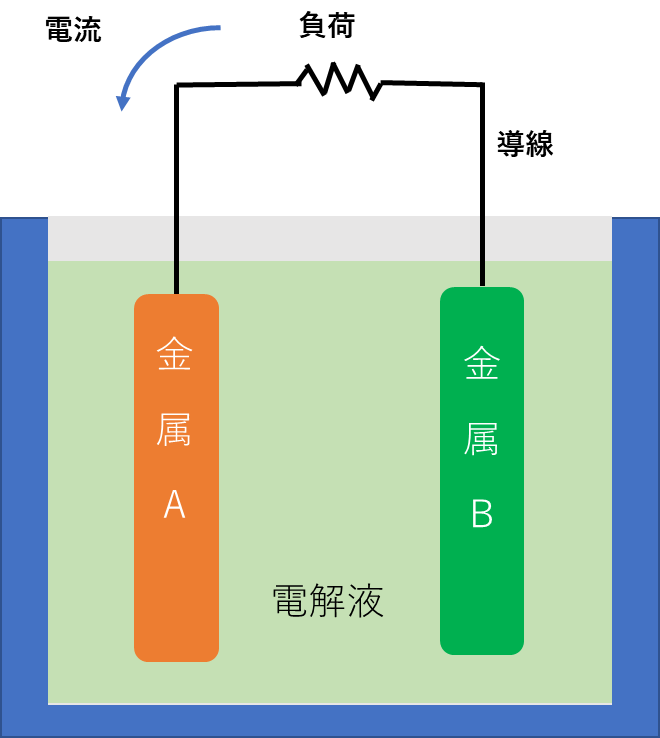
このように、電池って構造はとっても簡単で、だれでも出来てしまうのですが、なぜこんな簡単な構造で電気が出てくるのか、説明しようとするとこれが意外に難しいのです。
ということでゆっくり説明していきたいと思います。
まずは、電池を構成している金属と電解液の説明から。
金属の説明:自由電子が電気を運ぶ
金属だけでなく、物質は全て原子という小さな粒からできていて、原子は原子核とその周りを取り巻く電子からできている。原子核には陽子というプラスの粒子があり、電子はマイナスの電気を持った粒子です。ここまでは皆さん知っていることですよね。
それぞれの原子核に含まれるプラスの電気を持った陽子の数とマイナスの電気を持った電子の数は必ず同じですので、プラスとマイナスが打ち消し合って、原子全体としては電気を持っていない状態となっています。
金属というのは鉄とか、銅とか、鉛とか、身の回りにあるありふれた物質です。重くて、銀色とか銅色とかに輝く物質ですよね。金属も原子からできていますが、金属にはちょっと変わった性質があります。それは、自分のもつ電子のうち、いくつかが原子の外に飛び出してしまうということです。
金属原子からマイナスの電気を持った電子が飛び出すと、マイナスの電気が減ってしまうので、原子はプラスの電気を持つことになります。一方、飛び出した電子は金属原子の間を自由に飛び回ります。このような電子を自由電子といいます。そして、この自由電子が原子と原子の間を飛び回ることによって原子同士を強く結び付ける働きをします。このような原子と原子の結びつきを金属結合と言います。金属結合によって、金属原子は規則正しく並び、ぎっしりと詰まった形になります。これが金属結晶です。
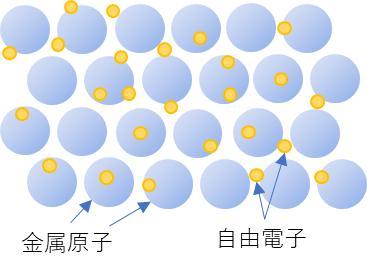
金属には硬く、重いという性質がありますが、これは原子がぎっしり規則正しく詰まっているからです。また、金属は電気を通しやすいという性質がありますが、これは自由電子が電気を運んでくれるからなのです。
繰り返していうと、金属原子はそれに含まれる電子が外れやすく、外れた電子は原子と原子の間を自由に飛び回りながら、原子どうしをむすびつけているという状態となっています。
電解液とは:イオンが電気を運ぶ
次に電解液の説明をしましよう。電解液とは電気を通す性質のある液体のことです。例えば水に少量の酸やアルカリ、塩類を加えると電気を通す電解液になります。なぜ、電気を通すようになるかと言えば、やはり原子と電子が関係しています。
例えば硫酸H2SO4を水に入れると水の中ではHとSO4に分かれます。このとき、Hは一つ電子が外れてプラスの電気を持つことになります。これをH+と書きます。一方、SO4は電子を二つもらってマイナスの電気を持ちます。これをSO42-と書きます。
水酸化カリウムKOHのようなアルカリを使った場合も同じで、水の中では、K+とOH―に分かれています。
このように酸やアルカリ、塩などを水に溶かすと電気を持った原子やSO4、OHのような原子のかたまり、原子団に分かれます。これをイオンといいます。プラスの電気を持ったイオンを陽イオン、マイナスの電気を持ったイオンを陰イオンとよびます。このイオンが電気を運ぶので、電解液は電気を通すというわけです。
ここまでが、基礎知識。金属と電解液の性質の説明をしました。
では、なぜ電気ができるのか
では、金属を電解液に浸すとどうなるのでしょうか。
具体的に金属として銅(Cu)と亜鉛(Zn)、電解液として硫酸水溶液を使った電池で説明しましょう。この電池をボルタ電池といいます。
Znは金属ですから、電子e-が飛び出して、プラスの電気を持った原子となって、その周りを自由電子が飛びまわっている状態になっています。このような金属Znを電解液に浸すと、Zn原子が自由電子の縛りから外れて電解液に溶け込もうとします。溶け込んだZn原子は電子2個を失ってZn2+という陽イオンになります。
Zn(金属) → Zn2+(陽イオン)+ e-(電子)
一方、電解質の中では、H2SO4が分離してH+という陽イオンとSO42-という陰イオンに分離しているということは既に述べました。
H2SO4(液体) → 2H+(陽イオン) + SO42-(陰イオン)
ここにZn2+という新たな陽イオンが溶け込んだらどうなるか。電解液にはもともとH+という陽イオンがあったわけですから、電解液の中は陽イオンが増えすぎてしまいます。
陽イオンが余剰となると、H+が、もう一つの金属であるCuから電子一つをもらって、イオンでない原子、つまり水素原子Hに変わります。ただし、水素原子は不安定なので、水素原子同士が二つ集まって水素分子H2となります。水素分子は気体ですから、泡になって電解液から出ていってしまいます。
2H+(陽イオン)+ e-(電子) → 2H(原子) → H2(気体)
つまり、Znが電解液に溶け込むと、陽イオンが余剰となるので、バランスをとるために水素イオンH+がいわば身を引いた形でイオンではなくなり、原子に戻ることになります。(そのあと原子に戻った水素は二つ集まって水素分子になります)
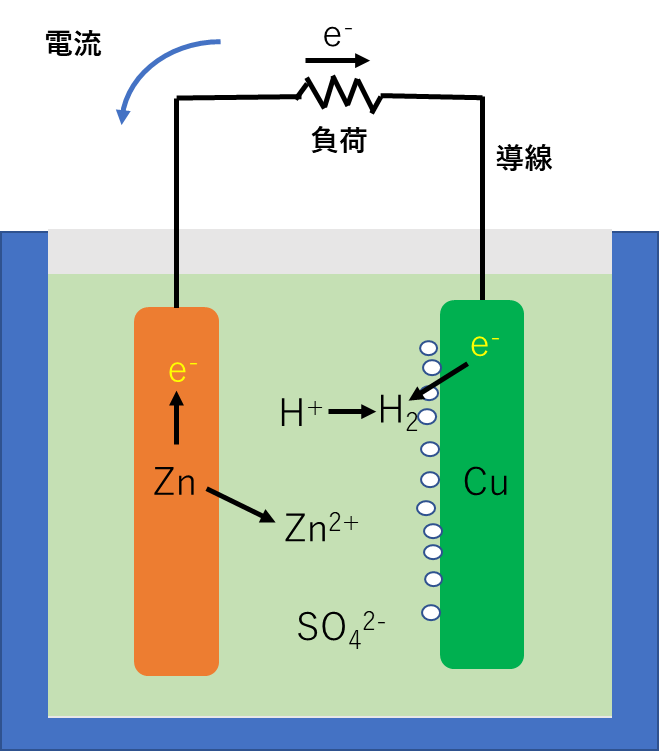
Cuは水素イオンから電子e-を取られてしまうので電子e-が不足してしまいます。一方、Znの方はZn2+が電解液に溶け込んだ分だけ電子e-が余剰となっています。ここで、ZnとCuというふたつの金属が導線でつながれていると、電子が導線を通って余剰のZnから不足のCuの方に移動することになります。この導線を通る電子e-の流れが電流です。
この電流は原理的には、電解液に溶け込んだZn2+の数が、SO42―の数と一致するか、金属Znがすべて電解液に溶け込んでしまうまで続きます。(実際は、発生した水素分子が泡状となってイオンの流れを阻害するという現象が起こってしまいます)
ここで疑問が
では、なぜZnがイオンとなって電解液に溶け込むのに、一方のCuが溶け込まないのでしょうか。あるいは、なぜZnがイオンになった分だけ、水素イオンがはじき出されて原子に戻ってしまわなければならないのでしょうか。
例えば亜鉛Znではなくて銅Cuが銅イオンCu2+になって電解液の中に溶け込んでもいいのではないでしょうか。この場合は電子の流れが逆になるはずです。
それは、Znが水素やCuよりもイオンになりやすい傾向があるからです。だから、ZnがCuに優先してイオンになります。イオンになりやすさをイオン化傾向といい、イオン化傾向は金属の種類によって決まっています。
だから、電池を作るときには一方の金属が、水素やもう一方の金属よりもイオン化傾向の大きい物を選ぶ必要があります。イオン化傾向の大きい方の金属が電解液の中にイオンとなって溶け込んで、導線に電子e-を押し出します。逆にイオン化傾向の小さい金属の方が電子e-を受け取ることになります。
電流は電子e-の流れの反対と考えますので、電池では電子を押し出す方、つまりイオン化傾向の大きい方がマイナス(負極またはアノード)。受け入れる方、つまりイオン化傾向が小さい方がプラス(正極またはカソード)ということになります。
また、負極と正極のイオン化傾向の差が大きいほど電子e-を押し出す強さが大きくなります。この電子e-を押し出す強さが電圧の元となります。
乾電池
私たちがよく目にする電池は、見かけ上ボルタ電池のような形はしていません。円筒型や立方体、あるいはボタン状で、中に電解液のような液体が入っているようにも見えません。
しかし、電気を発生する理屈は、ボルタ電池と同じです。ただ、使いやすいようにいろいろ工夫された結果、現在のような形になっています。
電池で一番問題なのは、電解液という液体を使うことで、電解液が電池の外に漏れたりすることがあります。乾電池では、電解液をペースト状にしたり、ガーゼにしみこませたりして、見かけ上、液体ではないようにして、液漏れを防いでいます。
また、ボルタ電池では電解液を入れる容器が必要でしたが、乾電池では負極に使われるZn自体を容器として使っていいます。このおかげでわざわざ容器を別に作る必要がなくなり、見かけもスマートになりました。
また、正極、負極に使われる金属や電解液についても工夫や改良が施されています。例えばよく使われるマンガン乾電池では負極は亜鉛Znですが、正極には銅Cu ではなくて二酸化マンガンMnO2が、電解液には硫酸ではなく、水酸化アンモニウムと酸化亜鉛が用いられています。
そのほか、乾電池には様々な種類がありますが、電気を産み出す基本的な原理は同じです。正極と負極に使う金属の種類や電解液に何を使うかが大きな違いです。
【関連記事】
欧州のEV化は日本車つぶしの陰謀なのか?
燃料電池車に未来はあるか FCVが普及しない理由
アメリカではどんな電気自動車(EV)が売られているか 53モデルのモーター出力、充電時間、走行距離、燃費など
(2)原子と原子量
(3)原子の構造 原子番号と原子量



