原子を分解したらどうなるのか
デモクリトスは、世の中のすべての物質は原子という、もうこれ以上分けられない最小の単位になると考えた。だからデモクリトスに言わせれば、原子はこれ以上分けることができない。しかしながら、そこんところをむりむり分解したらどうなるのか。と考えるちょっとへそ曲がりの人がいて、原子を分解しようとしたんだ。
20世紀の初めころ、金の薄い膜にアルファ線という放射線を当てる実験をやった人がいた。アルファ線は金の膜を透過してしまうけど、ごく一部が反射したり、曲がったりするという結果になった。この実験を知ったイギリスのラザフォードは、原子の中は一様ではなくて、原子の中に何か小さな硬い部分があると考えたんだ。
つまり、ふつう原子の中をアルファ線は透過してしまうけど、原子の中に硬い部分があって、それにたまたまアルファ線がぶつかったときだけ、反射したり曲がったりするとラザフォードは説明した。この硬い部分が原子核と言われるものだ。
その後、いろいろな実験や理論が積み重ねられた結果、原子は、図―1のような形をしていると考えられるようになった。
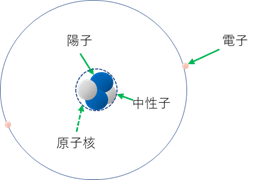
図―1 原子の構造模型
つまり、原子の中心に原子核という堅い部分があって、その周りを電子が廻っている。この形はちょうど太陽の周りを惑星が廻っている姿と似ているよね。
ラザフォードは原子核が硬い塊と考えたけど、その後の研究で、実は原子核も陽子と中性子という二種類の粒子からできていることが分かっている。
つまり、原子は中央に陽子と中性子から成る原子核があって、周りを電子という粒子が回っているという構造をしているんだ。
(注記)われわれの身の回りにはいろいろな物体があって、その物体は明らかにそこに「ある」ということが分かります。しかし、電子や原子核というような非常に小さいサイズになると実は、もう位置という尺度が通用しなくなります。だから電子は確かにあるのですが、どこにあるかは正確には分かりません。電子は原子核のまわりをまわっているというより、取り巻いていると言った方がいいのです。しかし、とりあえずは、原子核の周りを電子が廻っていると理解してください。
陽子、中性子、電子の重さ
では、原子の構造をもっと詳しく見て行こう。まず、原子核は陽子と中性子と電子からできているわけだけど、陽子1個の重さは1.673×10-24g、中性子1個の重さは1.675×10-24gだ。だれが重さを測ったのかは知らないけどね。一方、電子1個の重さは0.0009×10-24gしかない。
気が付いたと思うけど、陽子と中性子の重さはほとんど同じ。それに対して電子の重さは、陽子や中性子の重さの1000分の1よりもっと軽い。だから、電子の重さはほとんど無視できて、原子の重さは陽子と中性子の重さで決まると考えていい。
陽子、中性子、電子の電荷
もうひとつの大きな特徴として陽子はプラスの電気を持っていて、電子はマイナスの電気を持っていることが挙げられる。一方、中性子はプラスでもマイナスでもない電気的に中性。だから中性子というわけなんだけどね。
持っている電気の大きさを電荷という。電気の荷物という意味だね。そして電荷の大きさを示すのにC(クーロン)という単位が使われる。このクーロンという単位を使って陽子と電子の電荷の大きさを測ってみると、陽子の電荷は1.602×10-19C。電子の電荷は-1.602×10-19Cなんだ。
つまり、陽子の持つ電気と電子の持つ電気の大きさは、まったく同じだということが分かっている。電子の重さは陽子よりずいぶん小さいけれど、持っている電気の量から言えば陽子と同じというのは不思議だ。ただし陽子の電荷はプラス、電子に電荷はマイナスだけどね。
もう一つ、原子の特徴として、陽子の数とその周りをまわっている電子の数は同じというのがある。だから、陽子の持つプラスの電荷と電子が持つマイナスの電荷が打ち消しあって、原子全体としては見かけ上、電荷を持たず中性になるんだ。なお、中性子は電気を持っていないので、中性子の数がいくらあっても原子全体が持つ電気の量には関係ない。
ひとつの原子に含まれる陽子の数と電子の数は同じなんだけど、中性子はいくつあったもいいんだ。
原子番号と質量数
ではここで、原子番号と質量数という数字を覚えよう。
まず、原子番号は陽子の数と覚えればいい。簡単だよね。
原子番号=陽子の数
また、質量数というのは陽子の数と中性子の数を足したもの。これも覚えておこう。これも簡単。
質量数=陽子の数+中性子の数
ところで、前回説明した原子量は、水素原子の重さの何倍かという数量だったよね。
ある原子の原子量=ある原子の重さ÷水素原子の重さ
水素原子の原子核は陽子1個しかない(中性子はない)ので、水素原子の重さは、ほとんど陽子1個分の重さしかない。だから、ある元素の原子量は陽子と中性子を合計した重さになる。ということで、結局、原子量と質量数はだいたい同じ数字になるんだ。
ただし、質量数は陽子と中性子の「数」を足したものなので整数だけど、原子量は水素の重さの何倍かという数値なので、整数とは限らないという違いがある。
なお、原子の表し方としてこんな書き方をすることがあるので、これもついでに覚えておこう。あまり使わないけど、試験に出るかもしれないので覚えておいて損はない。
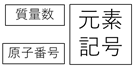
たとえば、マグネシウムMgなら原子番号(陽子の数)は12、質量数は24なので

のように表します。
具体的に見ていくと
では、原子番号や質量数、原子量について、具体的に例を挙げてみて行こう。
<水素H>
まず、元素の中で一番軽い水素は、図のような形をしている。元素の中で最も簡単な原子構造を持っていて、原子核には中性子が含まれず、陽子1個だけからできている。陽子と電子の数は同じなので、当然、電子の数は1個。
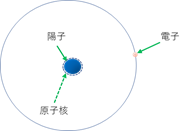
水素(H)原子(原子核は陽子1個だけ。電子も1個)
原子番号は1(陽子の数が1だから)
質量数も1(原子核は陽子1個だけだから)
原子量はほぼ1(1.00794 質量数とほぼ同じだ)
<ヘリウムHe>
2番目に軽いヘリウムHeは陽子が2個と中性子が2個。電子が2個でできている。
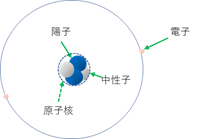
ヘリウム(He)原子(原子核は陽子2個と中性子2個、電子も2個)
原子番号は2(陽子の数が2個だから)
質量数は4(陽子2個+中性子2個)
原子量はほぼ4(正確には4.0028。質量数とほぼ同じだね)
<リチウムLi> 3番目に軽いリチウムLiは陽子3個と中性子は4個、電子は3個です。
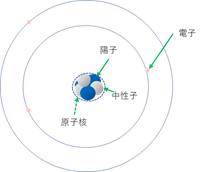
リチウム原子(原子核は陽子3個、中性子4個。電子は3個)
原子番号は3(陽子の数が3個だから)
質量数は7(陽子3個+中性子4個)
原子量はほぼ7(正確には6.968。質量数とほぼ同じ)
2021年7月25日
【目次】
(1)化学ってなに?/元素
(2)原子と原子量
(3)原子の構造 原子番号と原子量
(4)周期表を覚えよう
(5)同位体 トリチウム汚染水ってなに?
