新聞やテレビなどでトリチウム汚染水という言葉を聞いたことがあるだろうか。東日本大震災で事故を起こした東京電力の福島第一原子力発電所から出てくる水の中にトリチウムという物質が含まれているんだ。このトリチウムという物質は人体に害がある放射線を出すので、捨てられずにそのまま原発の敷地の中に貯められてきたんだけど、もう貯めるところが無くなってきたのでどうしようかという問題だ。
このトリチウムというのは水素の同位体と言われる物質だ。今回はこの同位体について勉強していこう。
1.ちょっと復習
その前に、今まで勉強してきたことをちょっと復習しよう。この世の中にある全ての物質は原子という小さな粒からできている。原子は原子核と電子からできていて、そして原子核はさらに陽子と中性子からできているという話をしたね。どんな種類の原子もすべて陽子と中性子と電子からできているんだ。図に書くとこんな感じ。
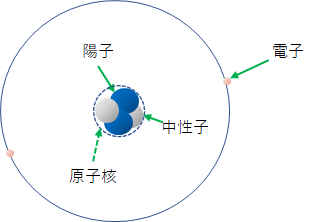
地球上には原子の種類つまり元素は、90種類くらいあるんだけど、その違いは陽子の数が違うということだ。例えば陽子が1個の原子は水素H という元素。陽子が2個ある原子はヘリウムHe、6個は炭素C、酸素Oは8個といった具合で、92個のウランUまで全部陽子の数が違う。このあたりは周期表を見て確認してほしい。
各元素には陽子の数が少ない方から番号がついている。この番号を原子番号というけど、結局、この番号は陽子の数と同じということになるよね。また、原子の重さを原子量というけど、これは陽子と中性子の数の合計と同じだ。そして、電子の数は陽子の数と同じ。
原子番号=陽子の数
原子量 =陽子の数+中性子の数
電子の数=陽子の数
2.では中性子の数は?
では中性子の数はいくつだろうか。実はこれは決まっていないんだ。だいたい、陽子の数と同じくらいの数だけど、必ずしもそうではない。
表1を見てほしい。これは原子番号1番の水素Hから12番目のマグネシウムMgまでの元素の陽子、電子、中性子の数を示したものだ。
表1 元素の陽子、電子、中性子の数(含有量の多い同位体の数値)
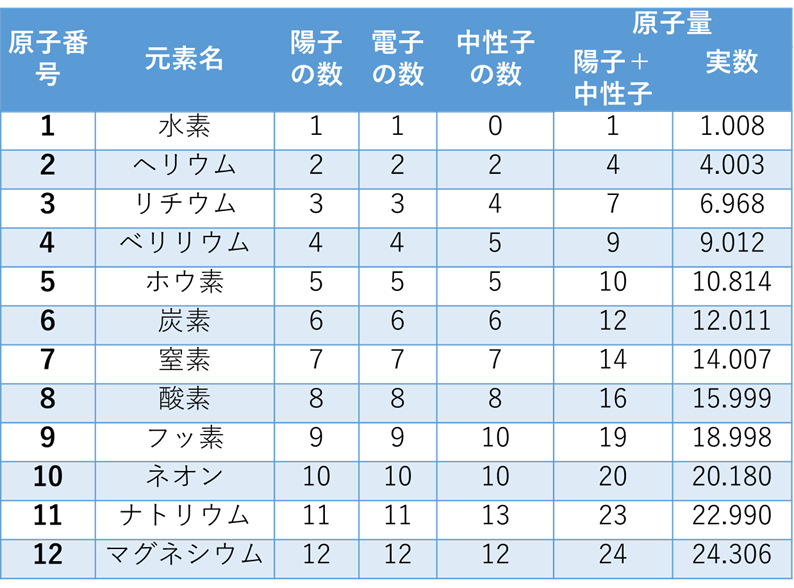
水素Hの場合は、陽子の数より中性子の数が1個少ない。つまりゼロ。リチウムLi、ベリリウムBe、フッ素Fの場合は1個多い。ナトリウムNaは2個多い。そのほかの元素は陽子と中性子の数は同じだ。(あっそれから中性子の数なんて特に覚えなくていいよ。)
3.同位体ってなに?
では、いよいよ同位体の話だ。陽子の数は元素によって決まっているけど、同じ元素でも中性子の数が違うものが混ざっていることがあるんだ。たとえば、表1の原子番号6の炭素Cを見てくれ。炭素は陽子の数が6個、電子の数も同じ6個。そして中性子も6個となっているのが普通の炭素だ。
ところが調べてみると、この炭素の中にわずかだが中性子が7個のものや8個のような変わり者が見つかっている。もちろん、陽子と電子の数はそれぞれ6個のままだ。
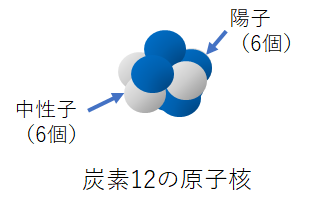
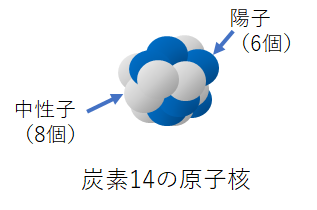
このように同じ元素でも中性子の数が異なる原子を互いに「同位体」という。
どうして同位体というかというと、同位体は中性子の数が違うけど、陽子の数が同じだから原子番号は同じ。(原子番号=陽子の数)。だから、周期表では同じ位置にある。同じ位置の原子という意味で同位体というんだ。英語ではアイソトープ(isotope)というけどね。
ちなみに、自然界にある炭素の中で中性子を7個持つものは1.1%、8個持つものは1.2×10-8%しかない。
4.同位体は重さが違う
このように同位体は陽子と電子の数は同じだけれど、原子の重さ、つまり原子量はどうなるかというと、当然違ってくる。原子量は陽子と中性子の合計だから、普通の炭素の場合は陽子が6個で中性子も6個だから合計は12。原子量は12ということになる。
中性子を7個持つものは陽子が6個で中性子が7個だから、合計の原子量は13、中性子を8個持つものは同じように計算して、原子量が14になる。原子量が12の炭素は「炭素12」、13の物は「炭素13」、14にものは「炭素14」と、元素のあとに原子量を添えて同位体であることを表すことになっている。
5.化学的な性質はほとんど同じ
同位体は重さが違うと言ったけど、化学的な性質は実は全くと言っていいほど変わらないということは覚えておいてほしい。というのは、原子の化学的な性質はだいたい電子の数によって決まる。同位体は原子の重さは違うけど、電子の数は同じだから、化学的な性質はまったくといっていいほど変わらないんだ。
だから、同位体を分離するときは、遠心分離や気体にしたときの拡散速度の違いのような原子の重さの違いを利用する。蒸留や吸着、結晶化など普通の化学物質の分離方法では分離することができない。
6.放射性同位体
ついでに放射性同位体の話をしておこう。
同位体の中には原子核が不安定で、何もしなくても勝手に壊れてしまうものがある。原子核が壊れるときは、放射線という物を出すという性質がある。このように、壊れながら放射線を出す同位体を放射性同位体という。英語ではラジオアイソトープ(Radio Isotope)というんだ。ラジオというのは放射性という意味だ。
原子核が壊れることを原子崩壊というんだけど、これにはアルファ崩壊、ベータ崩壊、ガンマ崩壊という種類がある。このあたりは高校化学基礎の範囲から外れるから特に覚えなくてもいい。けど、以下は参考までに読んでおいてくれ。
アルファ崩壊は、陽子2個と中性子2個をまとめて外に追い出してしまう現象。アルファ崩壊が起こると、当然、原子番号が2、原子量が4だけ小さくなる。追い出された陽子2個と中性子2個のかたまりをアルファ線というんだ。
ベータ崩壊は、主に中性子から電子1個が飛び出て陽子に変わってしまう現象だ。原子は原子核の周りを電子がまわって構造をしているけど、飛び出すのはこの電子じゃないので間違えないでくれ。ベータ崩壊の電子は原子核の中の中性子から飛び出すんだ。
ベータ崩壊すると原子量は変わらないけど、陽子が一つ増えて、原子番号がひとつ大きくなる。飛び出した電子の流れをベータ線という。(ベータ崩壊にはプラスの電荷を持った陽電子が放出される場合や、逆に外部から電子を取り入れて、陽子が中性子に変わってしまう場合もある)
ガンマ崩壊は、ガンマ線と呼ばれる電磁波を放出することによって、原子核が安定する現象だ。この場合は原子番号や原子量に変化はない。
原子崩壊によって放出されるアルファ線、ベータ線、ガンマ線が放射線と言われるものだ。そして、放射線を出す性質を放射能という。放射線は人体に有害なので注意が必要だね。
7.同位体の例
同位体について、ふたつほど例を挙げてみよう。
(1)トリチウム
最初に言ったトリチウムだけど、これは水素の同位体だ。普通の水素は陽子が1個、中性子はゼロだけれど、中性子を1個持ったものや2個持ったものがある。中性子を1個持ったものがデューテリウム(重水素)、2個持ったものがトリチウム(三重水素)だ。普通の中性子を持たない水素は軽水素と言ったりする。
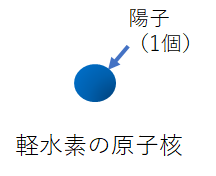
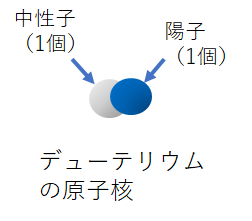
普通の水素(軽水素)はもちろん放射能を持たないけど、トリチウムはベータ崩壊してベータ線を放出する放射性同位体だ。ベータ崩壊すると、原子番号はひとつ大きくなってヘリウム3になる。
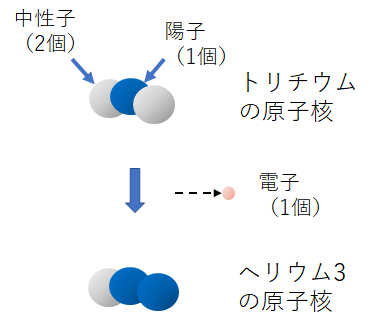
東京電力の福島第一原発ではトリチウムが原子炉の中で作られ、水の中の水素の一部がトリチウムに替わったトリチウム水になって、普通の水に含まれている。これをトリチウム汚染水と言ったりするけど、トリチウム水は化学的な性質が普通の水とほとんど全く変わらないから、普通の水からトリチウム水だけを化学的に分離することはとっても難しい。だから、どんどん増えて貯める所が無くなってきている。
ただし、トリチウム水から出てくる放射線はとっても少ないし、ベータ線そのものが比較的簡単に遮蔽できるので、薄めて海に捨ててしまってもいいんじゃねと考える人も、やっぱり駄目じゃねと考える人もいて、議論になっているんだ。
(2)炭素14
炭素14は普通の炭素12より中性子の数が2個多い同位体だ。これもベータ崩壊をして少しずつ窒素14に変わっていく性質がある。この性質を使って年代測定という便利な技が使える。
空気には二酸化炭素CO2が含まれている。この二酸化炭素に含まれる炭素14の割合は1.2×10-8%で一定している。植物が生きているときは、空気中の炭素を取り入れるので、その植物に含まれる炭素14の割合は空気の割合と同じだ。
しかし、その植物が死んでしまうと、もうその植物は空気中のCO2を取り入れなくなる。すると、その植物に含まれる炭素14がベータ崩壊して、一定の速さで窒素14に変わって減っていく。だから、植物に含まれる炭素14の割合を測定すれば、その植物が死んでからの年数を計算することができるんだ。この方法をC14年代測定法と言う。
例えば原始時代の人が食べ残した穀物に含まれる炭素Cに含まれる炭素14の割合を測定すれば、その原始人がその穀物を食べようとしたのが、何万年前かなんていうことが分かってくる。
このように、同位体は放射能を持っていたりして危険なこともあるけど、いろいろと役に立つこともいっぱいあるんだ。
2021年8月14日
【目次】
(1)化学ってなに?/元素
(2)原子と原子量
(3)原子の構造 原子番号と原子量
(4)周期表を覚えよう
(5)同位体 トリチウム汚染水ってなに?

